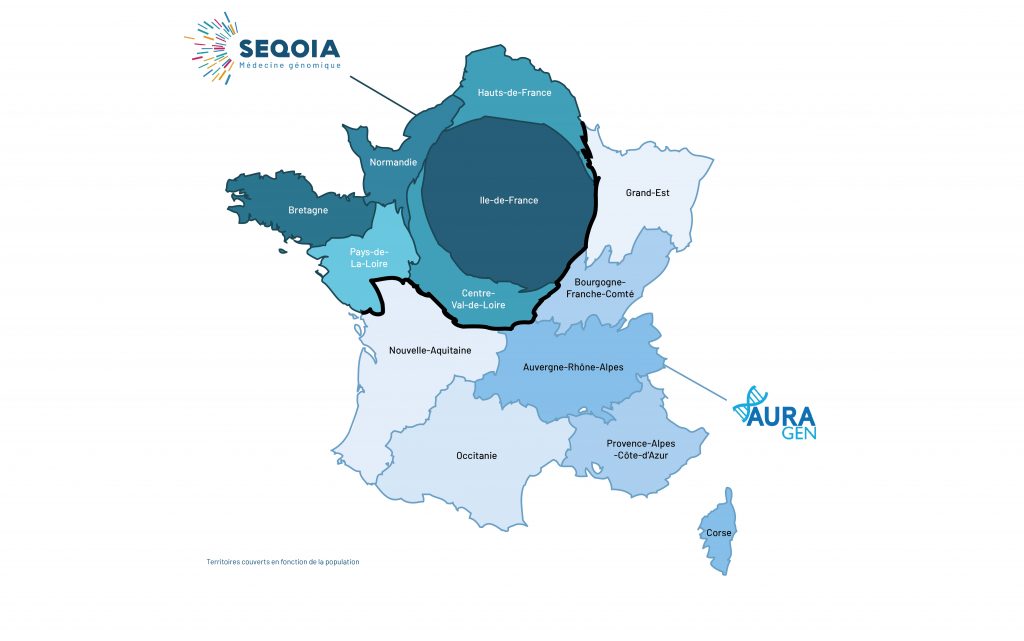
Les activités du laboratoire couvrent l’ouest et le nord de la France. Elles sont centrées sur l’introduction du séquençage du génome entier à haut débit dans la pratique clinique pour une série d’indications cliniques appelées « pré-indications ».
LE SÉQUENÇAGE GÉNOMIQUE
Nos chromosomes et nos gènes sont constitués par de l’ADN (acide désoxyribonucléique), qui contient l’information nécessaire aux êtres vivants pour survivre et se reproduire. Il se présente sous la forme d’une double échelle qui s’enroule sur elle-même. Chaque barreau de cette échelle est composé de bases, de petites molécules, appelées nucléotides, et qui sont au nombre de quatre : l’adénine (A), la thymine (T), la cytosine (C) et la guanine (G). Elles sont toujours apparentées par paires : A avec T, C avec G. Un peu à la manière d’un code informatique, l’ordonnancement de ces paires de bases le long de l’échelle d’ADN forme le code génétique universel de tout être vivant.
Repérer des mutations génétiques
L’enchaînement des nucléotides forme des gènes, qui sont l’unité de base de l’hérédité et qui vont fournir des instructions pour commander la production de protéines. Le nombre de gènes chez l’Homme est estimé à environ 20 000 gènes codant des protéines.
C’est l’ensemble de ce code génétique contenu dans l’ADN de nos cellules qu’on appelle le génome. Le séquençage du génome consiste donc à décrypter cet ADN en vue de déterminer l’ordre d’enchaînement des nucléotides qui le composent. Il va permettre également de repérer des mutations génétiques, lorsque des erreurs se produisent dans la réplication de l’ADN, à l’occasion de la division cellulaire.
La science génomique trouve des débouchés en médecine et peut être utilisée pour identifier et diagnostiquer des mutations génétiques responsables de maladies rares, de cancers ou de maladies chroniques communes (diabète par exemple) ou de prédispositions à des cancers par exemple.
Elle peut ainsi déboucher sur l’utilisation de l’information génomique des individus pour la mise au point de traitements thérapeutiques personnalisés ou d’approches prédictives.
La médecine génomique repose donc sur la capacité à pouvoir séquencer le génome individuel dans un temps limité et à un coût réduit. L’ADN a été découvert en 1953. Il a fallu ensuite 13 ans d’efforts et plus de 3 milliards de dollars pour séquencer le premier génome humain au début des années 2000. Les rapides progrès technologiques réalisés depuis ont permis la mise au point de séquenceurs à haut débit, et même à très haut débit, qui ont permis de réduire considérablement le temps et le coût du séquençage.
Vers une prise en charge médicale personnalisée
Le séquençage à très haut débit va permettre de favoriser l’intégration de la médecine génomique dans la pratique clinique et dans le parcours de soins du patient. Cela nécessite néanmoins des moyens importants dans le domaine bio-informatique (supercalculateurs, algorithmes) pour le traitement et l’analyse d’énormes bases de données.
Un nombre croissant de patients va ainsi pouvoir bénéficier du séquençage de leur génome et d’une prise en charge médicale personnalisée. En permettant l’analyse du profil génétique de milliers de patients, le séquençage génomique inaugure l’entrée dans une nouvelle ère de la médecine : une meilleure compréhension des mutations génétiques à l’origine des maladies, la mise au point de traitements plus personnalisés et d’approches prédictives.
LE TERRITOIRE COUVERT PAR LE LABORATOIRE SEQOIA
Aujourd’hui, deux plateformes sont opérationnelles sur le territoire français dans le cadre prévu par le Plan France Médecine Génomique 2025 : SeqOIA en Île -de-France et AURAGen en région Auvergne-Rhône-Alpes. La répartition de la prise en charge des analyses se fait en fonction de la localisation du patient et de son suivi selon la cartographie suivante :
LES PRÉ-INDICATIONS
Les analyses prises en charge par SeqOIA sont déterminées sur proposition du groupe « pré-indications ».
Ces pré-indications sont issues des avancées scientifiques et s’appuient sur un transfert de la recherche au soin. Concrètement, elles prennent la forme d’études de cohortes de patients avec une vision d’entrée dans un processus de remboursement pour l’indication étudiée.
Cette procédure permet aussi une montée en charge de l’activité de la plateforme.
Aujourd’hui, 61 pré-indications ont déjà été retenues dans le domaine des maladies rares, du cancer et des prédispositions au cancer.
De nouvelles pré-indications seront régulièrement ajoutées.
L’augmentation du nombre de pré-indications est corrélée à l’augmentation des capacités de la plateforme. En effet, le laboratoire de biologie médicale SeqOIA prendra en charge chaque année un nombre croissant d’analyses.
Maladies rares
Anomalies du développement, syndromes malformatifs et syndromes dysmorphiques sans déficience intellectuelle
(AnDDI-Rares)
———
Dystonies ou mouvements anormaux rares du sujet jeune
(BRAIN TEAM)
———
Ataxies héréditaires du sujet jeune
(BRAIN TEAM)
———
Leucodystrophies
(BRAIN TEAM)
———
Maladies neurodégénératives du sujet jeune
(BRAIN TEAM)
———
Paraparésies spastiques héréditaires du sujet jeune
(BRAIN TEAM)
———
Neurodégénérescence par accumulation intracérébrale de fer
(BRAIN TEAM)
———
Malformations cardiaques complexes congénitales
(Cardiogen)
———
Troubles du rythme héréditaires
(Cardiogen)
———
Cardiomyopathies familiales
(Cardiogen)
———
Maladies auto-inflammatoires et auto-immunes monogéniques
(FAI2R)
———
Maladie de Rendu-Osler
(FAVAMulti)
———
Syndrome de Marfan et pathologies apparentées, formes familiales d’anévrismes de l’aorte thoracique
(FAVAMulti)
———
Malformations artérioveineuses superficielles et du SNC à potentiel agressif
(FAVAMulti)
———
Maladies des artères de moyen calibre
(FAVAMulti)
———
Pathologies sévères du foie à révélation pédiatrique
(FILFOIE)
———
Myopathies
(FILNEMUS)
———
Hypotonies néonatales périphériques suspectes de maladies neuromusculaires
(FILNEMUS)
———
Maladies mitochondriales
(FILNEMUS)
———
Génodermatoses
(FIMARAD)
———
Entéropathies congénitales du jeune enfant
(FIMATHO)
———
Anomalies sévères de la différenciation sexuelle d’origine gonadique et hypothalamo-hypophysaire
(FIRENDO)
———
Insuffisance ovarienne primitive
(FIRENDO)
———
Dysfonction de l’axe thyréotrope
(FIRENDO)
———
Hypersécrétions hormonales hypophysaires
(FIRENDO)
———
Diabète néonatal
(FIRENDO)
———
Diabètes rares du sujet jeune et diabètes lipoatrophiques
(FIRENDO)
———
Déficits hypophysaires combinés (au moins 2 déficits antéhypophysaires) d’apparition néonatale ou plus tardive
(FIRENDO)
———
Syndrome de Cushing par hyperplasie nodulaire bilatérale des surrénales
(FIRENDO)
———
Maladies héréditaires du métabolisme
(G2M)
———
Aplasies et hypoplasies médullaires
(MaRIH)
———
Déficits immunitaires héréditaires
(MaRIH)
———
Neutropénies chroniques sévères
(MaRIH)
———
Histiocytoses sans mutation BRAFV600E
(MaRIH)
———
Maladies constitutionnelles du globule rouge
(MCGRE)
———
Pathologies de l’hémostase
(MHEMO)
———
Dysraphismes
(NeuroSphinx)
———
Néphropathies chroniques
(ORKiD)
———
Pathologies rares du métabolisme phospho-calcique ou de la minéralisation dentaire
(OSCAR)
———
Maladies osseuses constitutionnelles
(OSCAR)
———
Maladies respiratoires rares
(RespiFIL)
———
Dystrophies rétiniennes héréditaires
(SENSGENE)
———
Malformations oculaires
(SENSGENE)
———
Surdités précoces
(SENSGENE)
———
Formes syndromiques de maladies rares à expression bucco-dentaires
(TETECOU)
———
Epilepsies pharmacorésistantes à début précoce
(DéfiScience)
———
Malformations et maladies congénitales et très précoces du cervelet et du tronc cérébral
(DéfiScience)
———
Schizophrénie syndromique
(DéfiScience)
———
Malformations cérébrales
(DéfiScience)
———
Déficience intellectuelle
(DéfiScience)
———
Troubles du spectre autistique ou troubles précoces et sévères du neuro-développement – sans déficience intellectuelle, de formes monogéniques
(DéfiScience)
Oncogénétique constitutionnelle
Cancers avec phénotypes tumoraux
« extrêmes » et sans antécédents familiaux
(Groupe Génétique et Cancer)
———
Cancers avec antécédents familiaux particulièrement sévères
(Groupe Génétique et Cancer)
Cancer
Leucémies aigües réfractaires ou en rechute chez l’adulte
———
Cancers et leucémies pédiatriques en échec de traitement
(SFCE)
———
Lymphomes B diffus à grandes cellules en rechute ou réfractaires
(GBMHM)
———
Lymphomes de diagnostic incertain
(GBMHM)
———
Cancers rares
(SCOPP/ GFCO)
———
Cancers de primitif inconnu
(SCOPP/ GFCO)
———
Cancers avancés en échec thérapeutique
(SCOPP/ GFCO)
———
Cancers et leucémies Pédiatriques au Diagnostic
(SFCE)
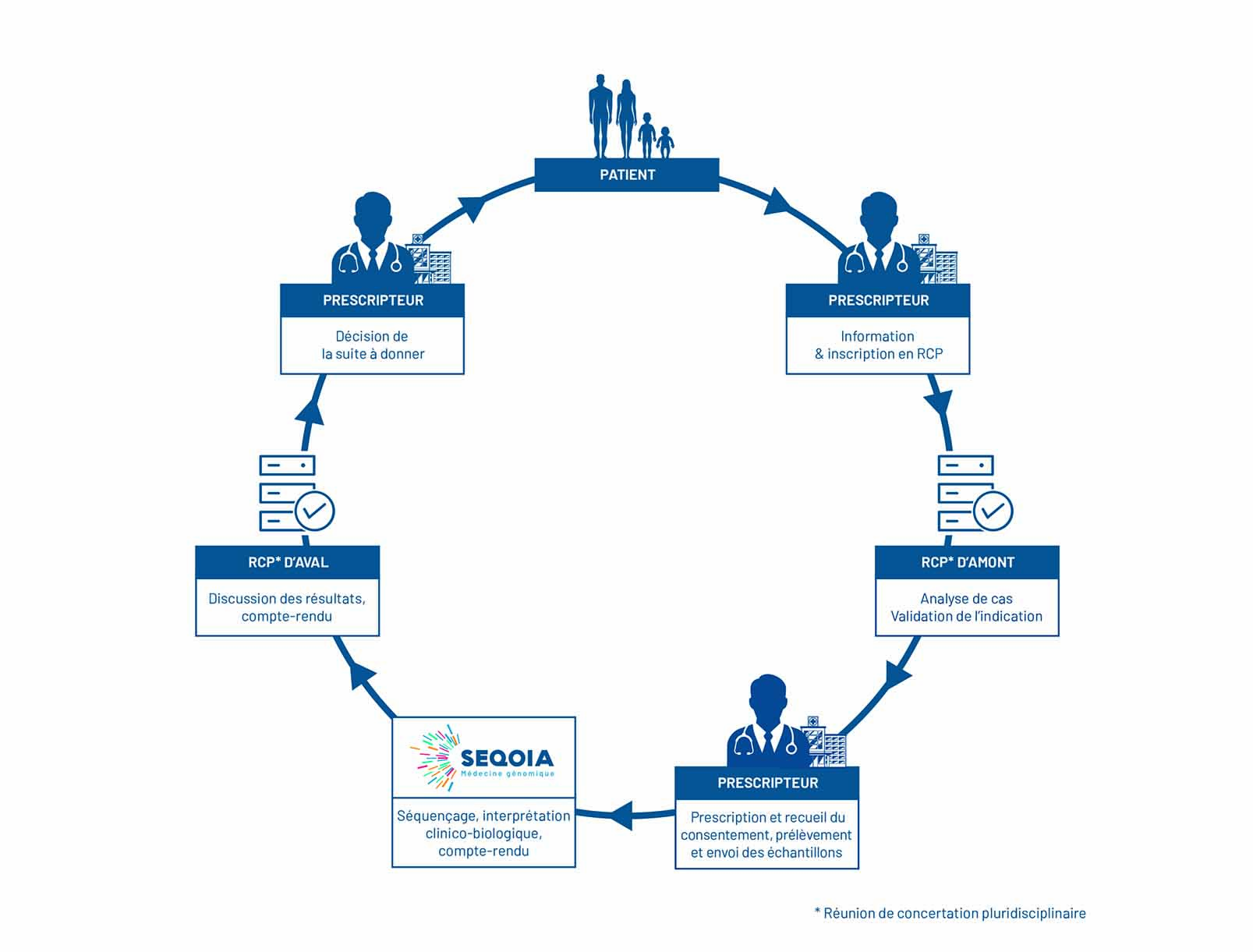
LE PARCOURS DES ANALYSES
Les analyses suivent un parcours précis, de la prescription jusqu’à la restitution des résultats au patient.
Pour chaque pré-indication, des médecins référents ont été désignés et sont en charge de la structuration et de la coordination du parcours des analyses. Ils ont désigné des cliniciens experts « prescripteurs » : ce sont par exemple des médecins spécialistes au sein de centres maladies rares, de centres de lutte contre le cancer ou de CHU.
Les Réunions de Concertation Pluridisciplinaires (RCP)
Le Laboratoire de Biologie Médicale SeqOIA est adossé sur le plan clinique, à des Réunions de Concertation Pluridisciplinaires qui disposent d’outils informatiques spécifiques et indépendants de l’outil de e-prescription du LBM SeqOIA.
- les RCP d’amont valident l’indication à une analyse pangénomique
- les RCP d’aval qui discutent de l’interprétation des résultats fournis sous la forme d’un compte-rendu d’examen de biologie médicale et des conséquences pour la prise en charge
Ces RCP sont thématisées autour d’une ou plusieurs pré-indications et organisées de façon à assurer une couverture territoriale de l’accès aux analyses pangénomiques.
Chaque RCP rassemble l’ensemble des experts nécessaires et est coordonnée par un ou plusieurs responsables.

La prescription d'un examen pangénomique
Le parcours génomique est entièrement dématérialisé. Un outil informatisé de prescription et de suivi des analyses, dénommé SPICE, a été mis en place. Les prescripteurs et l’ensemble des membres des RCP peuvent accéder à cet outil développé et géré par les équipes de la plateforme bio-informatique SeqOIA-IT.
Cliquez ici pour les modalités d’accès à l’outil SPICE.
Pour tout renseignement, vous pouvez nous contacter à spice-prescription@bioinfo.aphp.fr
Le recueil du consentement du patient ou des apparentés
La prescription d’une analyse génomique s’accompagne du recueil obligatoire du consentement du patient ou des apparentés. Les consentements spécifiques ainsi que des notices d’information ont été élaborées dans le cadre du Plan France Médecine Génomique 2025. Elles sont téléchargeables sur notre page Notre documentation.